合成生物学是生物学和工程学相交叉的一门学科,在合成生物学的体系中,为了构建具有特定生物功能的细胞工厂,需要引入多种外源基因模块。在构建的人工底盘细胞中,通过设计复杂的催化反应和路径实现绿色反应过程,为许多化学产品提供了一种更加安全环保的合成方法。现阶段,天然产物异源合成仍面临诸多问题,其中一个重要的问题是外源基因导入宿主后其表达、定位和组装模式存在不确定性,进而引起一系列不良效应:异源酶的错误定位导致的酶与底物分隔,合成产物所需的前体被内源竞争性路径消耗,上下游酶之间的表达不平衡以及多种外源酶的组装不当导致的难以实现协同催化作用等。这些问题极大地限制了外源基因在细胞工厂中的功能发挥。
研究人员在天然系统中发现,参与连续反应的酶形成多酶组装系统后会极大地提高反应效率,如在色氨酸合成酶和氨基甲酰基磷酸合成酶的催化系统,通过酶的组装实现了多酶的协同催化,提高了催化效率。受此启发,研究人员尝试开发出各种人工生物支架系统,以便将导入到底盘细胞中的外源蛋白按照预期设计的方式组装到一起,形成多酶聚集的催化体系,从而提高天然产物的异源合成效率。随着对支架研究的深入,研究人员已经开发出多种多样的生物支架系统,根据支架分子的核心成分可将其分为两大类,即蛋白支架和核酸支架。
其中蛋白支架是以支架蛋白为结构核心募集目标酶,利用蛋白-蛋白相互作用将多种酶对接形成的多酶组装体。而核酸支架是以核酸分子为支架结构,利用DNA或RNA与酶的特异性结合,将多种酶聚集到支架结构中,形成酶的有序组装系统。另外,近年来在组织工程或生物材料工程领域也开发了蛋白支架系统,该系统主要应用于组织或器官尺度的修复, 此类蛋白支架组成主要是胶原蛋白或丝素蛋白高分子聚合体,这与本文中提到的胞内生物大分子尺度的蛋白支架(主要是支架蛋白质)相比,在空间尺度和应用领域方面具有显著的区别。
1 生物支架系统的种类及其应用
1.1 蛋白支架
1.1 普通型蛋白支架
来自哺乳动物中的结构域和配体已被证明能够在大肠杆菌和酿酒酵母等微生物中正常表达。一种经典的蛋白支架是Dueber等将来源于小鼠的SH3 和 PDZ 结构域与来源于大鼠的 GBD 结构域通过短肽连接组装成的一个蛋白支架(GBD)x(SH3)y(PDZ)z。在酿酒酵母中将甲羟戊酸途径中的三个基因AtoB、HMGS、HMGR通过相应配体依次与蛋白支架的 GBD、SH3、PDZ 三个结构域结合,并使这些路径编码酶的基因受诱导型启动子的异源转录调控,从而实现了工程化人工蛋白支架的构建。通过调节支架上结构域的数目协调多酶之间的化学计量比,从而解决了多酶组装系统表达量不平衡的问题,使甲羟戊酸的产量提高了77倍。该支架已成功地应用于其他多种目标分子的生物合成,包括葡萄糖二酸、儿茶素、氢气、白藜芦醇、丁酸、γ-氨基丁酸以及衣康酸等,均获得了良好的效果。
基于亲和体的相互作用是蛋白支架进行多酶组装常用的手段。Gao 等从后生动物细胞中选择
PDZ域和相应的配体 (PDZlig) 作为八聚体亮氨酸脱氢酶LDH和二聚体甲酸脱氢酶FDH相互作用的平台,构建了一个自组装的 NADH 回收系统。Kang等将分别来源于cAMP独立蛋白激酶和A激酶锚定蛋白的两个短肽 RIAD 和 RIDD 分别融合到MVA 路径的最后一个酶 idi1 和类胡萝卜素的第一个酶 CrtE 上,利用 RIAD 和 RIDD 的自发结合在大肠杆菌中实现了自组装的酶共定位体系,使类胡萝卜素的产量提高了5.7倍。将相似的策略应用到酿酒酵母中,使番茄红素的产量提高了58%。Z结构域亲和体由于其体积小,具有快速折叠的动力学和稳定性,是多酶组装的合适标签。目前研究人员已经研究出了靶向包括葡萄糖、HER2、Taq 聚合酶和IgA等蛋白的Z结构域亲和体。Tippmann等在酿酒酵母中利用 anti-ZTaq与 anti-ZIgA通过接头连接到一起形成一个支架,分别将法尼基二磷酸合酶融合到ZTaq,法尼烯合酶融合到ZIgA,通过蛋白的亲和相互作用,实现了这两种酶共定位,改善了通过
甲羟戊酸途径通向法尼烯的通量,在此支架的基础上添加一对ZHER2∶anti-ZHER2组成三组分支架,将蓝藻来源的多羟基丁酸酯(PHB)途径的三种酶通过蛋白支架共定位,在大肠杆菌中使PHB的产量相比于未使用支架时提高了7倍。
1.1.2 脂质型蛋白支架
脂质型蛋白支架是一种广义分类,包括脂质参与组建的支架或脂质(膜)定位的支架。许多有用的酶,如真核细胞色素 P450 酶和各种萜烯合酶都需要结合生物膜发挥催化功能,有的酶还有特定的脂质需求,这限制了它们可以与哪些膜相互作用。将蛋白质支架技术与生物膜相关酶兼容,则可以改善许多有价值的次级代谢产物的生物合成。脂质作为构成生物膜的主要成分,对改善支架性能具有重要作用,这主要得益于脂质自身的特性:脂质可以充当膜蛋白的锚,它们也可以形成膜屏障,允许小分子选择性地运入和运出隔室。Myhrvold 等将来源于 ϕ6 噬菌体的膜蛋白 P9 和非结构蛋白P12在大肠杆菌中组装成合成型含脂质蛋白支架 (synthetic lipid-containing scaffolds,SLSs),其中P9与脂质形成支架,P12是装配因子。通过将各种目标蛋白融合到P9 的 C 末端,可以使特定酶定位在该支架上,为验证该支架的实际效果,他们将合成靛蓝的两个连续的酶通过SLS进行共定位,观察到靛蓝产量明显提高,这说明脂质是一种可利用的支架材料。
脂质型蛋白支架多以膜结合支架的形式存在,膜结合的支架系统可以通过将合成途径限制在限定的细胞器中来更好地控制细胞内新陈代谢的空间组织。通过特异性短肽引导蛋白支架定位于特定部位,可以形成具有特殊定位的蛋白支架。Lin等将两个 cohesin 模块分别融合了脂滴定位的油脂蛋白(Ole),构建了一个脂滴定位的蛋白支架,将乙酰辅酶A合成路径分支中的醛脱氢酶(Ald6)和乙酰辅酶A合成酶 (Acs1) 分别通过支架定位于脂滴,
与内源性位于脂滴的醇-O-乙酰基转移酶 (Atf1)形成共定位多酶途径,使乙酸乙酯的产量相比非支架途径提高2倍。油脂蛋白本身也可以在脂质液滴中形成同聚寡聚体,调节油脂蛋白的氨基酸组成会改变脂质液滴的形态,这表明人们可以创造工程化的油质蛋白支架的超复合物,甚至可能通过定制的脂质液滴形态进一步调整支架酶的空间排列。
1.1.3 微室型蛋白支架
蛋白支架除了可以将目标蛋白聚集在一起,还可通过将多酶封装到密闭微室中,形成类似于细胞器的独立代谢空间。研究人员已经在真核生物的细胞器工程中取得显著突破,Farhi和Avalos等分别将线粒体作为高效生产天然产物的亚细胞工厂,Liu 等在酿酒酵母的过氧化物酶体中高效表达鲨烯的代谢路径,这说明代谢工程中的区室化策略是天然产物异源合成的一种有效手段,借助于微室型蛋白支架可以在原核生物中实现细胞中代谢路径的
区室化封装。
天然存在的常见的微室有两种:一种是细菌微区室 (bacterial micro-compartments,BMCs);另一种是病毒样颗粒(virus-like particles,VLP)。细菌微区室是细胞器的原核形式,由半透性蛋白质外壳组成。当前,存在三类已知的细菌微区室:固定CO2的羧基体 (CB)、 1, 2-丙二醇利用微区室(PDU)和乙醇胺利用微区室。
CB是第一个被发现的BMC,并且仍然是用于阐明 BMC 如何在细胞中组装和起作用的模型系
统。它的外壳由大约800个蛋白质六聚体和12个五聚体组成,六聚体形成二十面体的小平面,五聚体形成顶点。管腔内部是核糖1,5-双磷酸羧化酶/加氧酶(RuBisCO) 和碳酸酐酶 (CA),它们与壳蛋白通过蛋白之间的相互作用被封装到微室中。羧基体通过增加局部 CO2浓度将碳固定率提高了三倍,从而克服了RuBisCO的缓慢周转率。Bonacci等在大肠杆菌中构建出模块化碳固定微区的遗传系统,这为设计独特的固碳生物体或改善现有的有氧合光合器提供了参考。
1.2 核酸支架
1.2.1 RNA型支架
尽管合成蛋白型支架是多酶组装的有用的平台,但是随着多酶系统的复杂性增加,全长和功能性蛋白支架可能难以表达。得益于核酸碱基的易于设计和合成,研究人员能够创建各种基于DNA 或RNA的纳米支架以组装多酶复合物。Delebecque等设计了一种 RNA 模块,该 RNA 能够自发折叠形成两个配体结合域分别结合PP7和MS2蛋白,当目标蛋白融合了 PP7 或 MS2 蛋白后,便能够被该RNA 支架组装到一起。利用工程化的 RNA 模块,该作者分别组成了离散的、一维的、二维的支架结构,并将其应用到生物制氢的代谢路径中,使氢的产量比不使用支架提高48倍。
基于 RNA 的支架相比于蛋白型支架允许在纳米精度上形成更加复杂多维的结构,但同时 RNA支架的应用因RNA 结构不稳定而受到限制,所以开发更加稳定的支架是十分必要的。DNA 凭借其优势成为一种优于RNA的支架材料:一是DNA支架结构的稳定性在很大程度上与序列长度无关,因此可以生成更多序列长度的支架而不会降低其稳定性;二是自然界中存在大量不同的DNA结合蛋白,可以加以借鉴改造以生成人工支架。
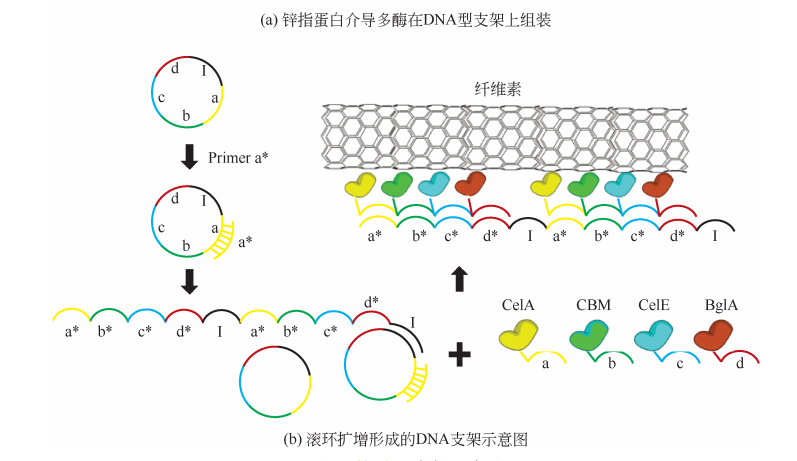
1.2.2 DNA型支架
Wilner等将经过DNA寡核苷酸化学修饰的葡萄糖氧化酶 (GOx) 和辣根过氧化物酶 (HRP) 定位 在 通 过 滚 环 扩 增 (rolling circle amplification,RCA) 获得的DNA单链上,并使用DNA聚合酶重复扩增了 GOx和 HRP 结合序列。扩增后的 DNA 链可使酶在较低浓度下进行多酶级联反应,在同样浓度下,未组装的酶不具有完整的级联活性。这证明了使用DNA 支架将酶有序组装可实现激活催化反应的功能。然而,单链DNA 支架缺乏刚性并且可
能导致支架的意外折叠。
2 生物支架系统的作用机制
关于生物支架的作用机制目前有两种观点。一种观点认为多酶组装系统通过分子支架形成了“底物通道”,底物通道化是指在生物代谢过程中底物从一个酶直接转移到另一个酶的过程。在稳定的多酶组装体中,反应中间体被完全封闭在该蛋白质的内部通道或腔室,只能在活性位点之间定向转移。自然界中的色氨酸合酶被认为是底物通道的一个典型例子,色氨酸合酶复合物的α亚基和β亚基相结合,在两个亚基的活性位点之间形成封闭的疏水通道,这种结构有助于反应中间体吲哚从α亚基快速转移到β亚基,并催化吲哚转化为
色氨酸,产率接近100%。底物通道化通过防止中间体在整个细胞中扩散以避免它们被竞争途径代谢,从而提高产品产量,对于底物通道能否提高反应速率,Sweetlove等在综述中指出,底物通道只有在扩散成为反应速率的限制因素时它才能提高稳态下的反应速率,但在大多数情况下,扩散并不是反应速率的限制因素,而之所以许多研究中都报道了支架酶使反应速率提高数倍,这归因于这些研究缩短了“滞后时间”。
3 结语
多酶的协同催化是代谢工程中难以绕开的课题,虽然可以通过简单的酶融合实现两种酶或三种酶的协同催化,但当涉及复杂路径时,多酶融合可能会形成难以预测的空间结构,融合策略就十分受限制,尤其是对于一些复杂天然产物的从头合成,可能会涉及十几个酶,此时生物支架系统将会发挥重要作用。目前已发现一种微室型蛋白支架能够封装300多个酶,这为封装一整条代谢路径提供了可能性,基于此可以在细胞内构建一个独立的“细胞器”作为高效生产特定产物的人工细胞器工厂,但目前这种策略仍面临一些问题,比如如何筛选具有合适选择透过性的衣壳蛋白。
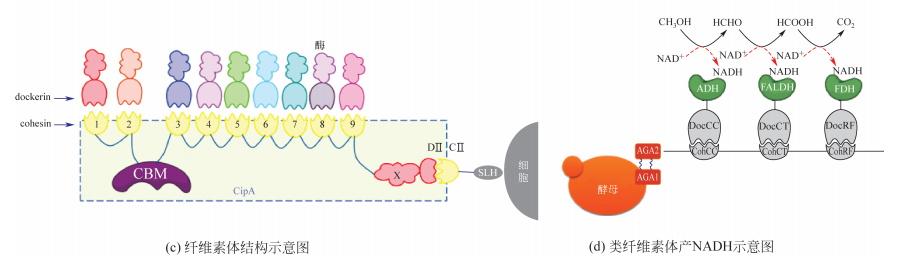
除了在代谢工程领域的应用,生物支架系统对于复杂聚合物的降解也提供了一种理论上可行的方法PET。塑料的酶研究人员已经发现天然菌株中存在一种降解,但因其自身催化效率极低且涉及多酶协同催化,一直未能得到有效地利用,构建胞外的类纤维素体人工蛋白支架或许可以帮助解决困扰人们的“白色污染”问题。
此外,蛋白支架在体内信号传导、分子试剂、纳米材料等领域也有广泛应用。在未来,将蛋白支架技术与纳米技术相结合,在体内构建出能够智能组装且稳定存在的分子机器,将会给合成生物学领域带来全新的突破。
AWSG爱保信(Biotech)投行事业部,由深耕生物医药领域多年的资深投行专家以及来自国内外顶尖院校的生物医药专业博士组成,致力于帮助全球最好的生物技术产业化和资本化,以资本、人才、技术资源助力,全链条全周期地陪伴生物医药公司共同生长,成为生物医药公司背后最坚定的助跑者。
